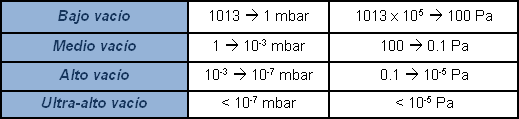PROPIEDADES y LEYES DE LOS GASES Las mismas describen las relaciones entre las variables de estado, presión (p), temperatura (T) y volumen (V), de una determinada cantidad de gas (de masa m, de número de partículas N, de cantidad molar n). Las leyes son simples relaciones que han sido encontradas mediante la experiencia y se refieren, sin embargo, al <>. Las moléculas del gas se consideran puntiformes, entre ellas no debe interactuar alguna fuerza y deben chocar en modo elástico entre ellas y con las paredes que delimitan el espacio.
El VACÍO , conceptualmente hablando, es la ausencia total de materia que probablemente posee un significado filosófico más amplio (Horror Vacui). Dentro del ambiente técnico se reconoce como VACÍO el espacio en el cual la presión es inferior a aquella atmosférica. El VACÍO ABSOLUTO es considerado ausencia de materia en un espacio de volumen, sin embargo no es realizable. Mejor definirlo como el mejor vacío que se puede generar en el interior de un espacio, dado que no es posible eliminar por completo todos los gases (hidrógeno, oxígeno, nitrógeno, neón, y argón son ejemplos de gases permanentes). Además, a menudo es normal escuchar que se entiende el vacío como entidad física, y de aquí es contrapuesto al concepto de presión. En realidad, la presión es la única entidad de medida, tanto para valores mayores que la presión atmosférica que para valores inferiores a la misma.
Definimos PRESIÓN al resultado de una fuerza que actúa perpendicularmente sobre la unidad de superficie. Los gases están constituidos por un gran número de partículas continuamente en movimiento. Cuando las mismas colisionan sobre una superficie, dichas colisiones generan un impulso que puede ser medido como fuerza. La presión es la suma de todas las fuerzas producidas por las partículas sobre la unidad de superficie. Las partículas que componen los gases, cuando se encuentran en equilibrio termodinámico, se distribuyen uniformemente en el espacio, así, la presión y composición del gas es uniforme en cada punto del contenedor.
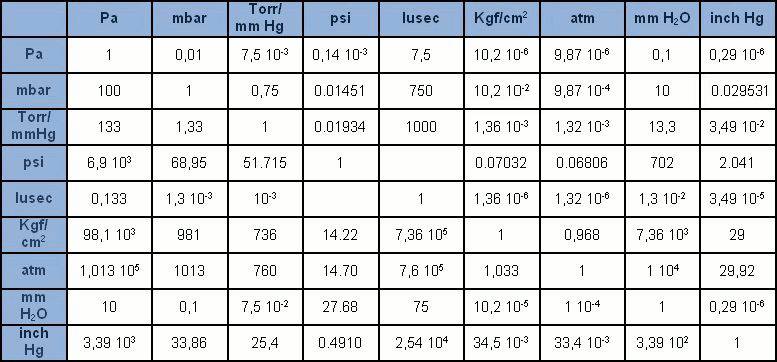
La unidad de medida en el sistema internacional (SI) es el pascal [Pa], que considera la presión resultante de la fuerza de un newton [N] sobre una superficie de un metro cuadrado [m2]. El pascal, sin embargo, es una unidad de tamaño algo pequeño comparado con las unidades precedentemente utilizadas. Por tanto, se expresa generalmente con sus múltiplos: hPa = 100Pa (1 mbar), kPa = 1.000Pa (0,1 bar), MPa = 1 millón de Pa (10 bar). Tolerado el uso del bar y del mbar, el Pa y sus múltiplos lentamente están reemplazando las numerosas unidades de medida de presión que en el pasado estaban muy difundidas (mmHg, mmH2O, Torr, atm, psi). En la tabla se presentan algunas de las de medidas de presión más utilizadas con sus correspondientes factores de conversión.
La presión atmosférica vale aproximadamente un bar absoluto (1013 mbar), un manómetro que señala cero a la presión atmosférica y muestra en cambio una señal negativa en vacío, mide la presión relativa como un alejamiento respecto de la presión atmosférica. En realidad no existen presiones negativas. En algunos casos se indica con un porcentaje el valor de vacío producido, considerando 100% el vacío absoluto; no es lo bastante representativo y la extensión del campo de aplicación hace que tal indicación resulte subjetiva. Es más correcto expresar el valor de presión, o vacío, indicando el valor absoluto. Dado que un valor cero de presión es prácticamente inalcanzable, la indicación del valor de vacío será un decimal con muchos ceros después de la coma según sea bajo el valor de presión, o sea "alto" el valor del vacío. Por motivos prácticos se utilizan expresiones logarítmicas en vez de la escritura de una infinidad de ceros antes de un número significativo. Además, para evitar interpretaciones subjetivas, el campo de las presiones inferiores a aquella atmosférica, definido vacío, es subdividido con diferentes indicaciones sobre el nivel.