Es la condición que se instaura a través de un conducto o un capilar (fuga o pérdida). En la tecnología del vacío se pueden distinguir tres regímenes de flujo diferentes:
- el régimen viscoso o laminar: verificable en la presión atmosférica, las moléculas, numerosas, se mueven en modo casi compacto dando un flujo y un sentido a la corriente; predominan de este modo los efectos físicos debidos a la densidad del gas como la viscosidad dinámica. La dirección preferencial de todas las moléculas del gas es la misma que la dirección macroscópica de la corriente de gas come se observa en la figura siguiente. El flujo es gobernado por las fuerzas viscosas y es constante en el tiempo;

La ley que describe el flujo viscoso a través de una sección tubular de sección circular es la ley de Poisseuille:
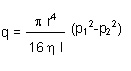
- Donde con r se indica el radio del tubo, con l la longitud, con ? la viscosidad dinámica del gas y con p las diferentes presiones.
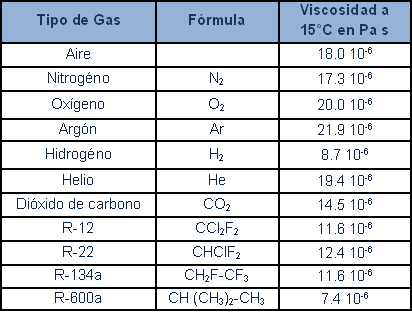
El siguiente cuadro muestra la viscosidad dinámica principal de los gases y refrigerantes:
el régimen molecular se verifica donde la densidad de las moléculas es menor, es decir en condiciones de vacío forzado y, en términos de libre camino medio, las probabilidades de colisión entre molécula y molécula son inferiores a las probabilidades de coalición molécula-pared. En cambio predominan las colisiones de las partículas contra las paredes. Como resultado de las reflexiones elásticas y de la desabsorción una partícula de gas asume una dirección casual y por lo tanto no se presenta un desplazamiento macroscópico. El movimiento del fluido tiene lugar en modo caótico, sin seguir trayectorias ordenadas como en el caso del régimen laminar.
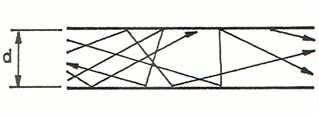
La fórmula que gobierna el régimen molecular es la siguiente:
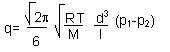
Donde con R se indica la constante de los gases perfectos, con T la temperatura absoluta, con M la masa relativa, con d el diámetro del tubo, con l la longitud y con p las presiones.
- el régimen (transitorio) de Knudsen es de difícil definición ya que resulta problemático definir también a qué leyes se someten los gases en el pasaje de un flujo viscoso a uno molecular, o viceversa.
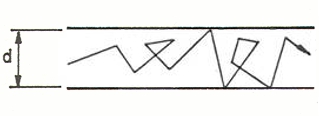
Se puede ofrecer una fórmula como suma de las contribuciones de los otros dos regímenes.
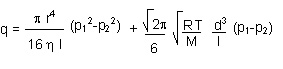
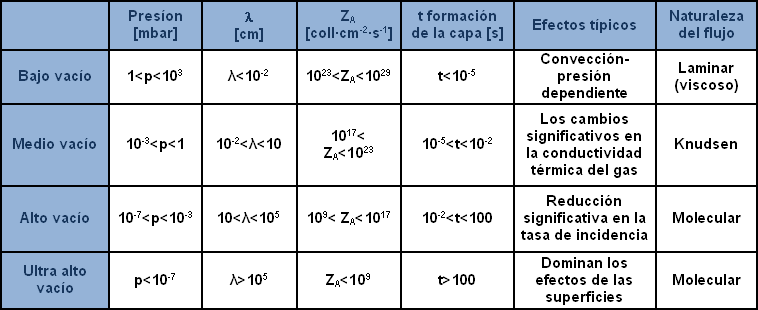
Para reconocer mejor las típicas regiones de vacío y de flujo que se instauran al interno de la pérdida, útil para la definición de un proceso o para la rápida individuación del componente mayormente apto, ha sido subdividido el campo entero de las bajas presiones o del vacío (como se prefiera llamarlo) en diferentes regiones, en base a los diversos efectos típicos y a la naturaleza del flujo (como puede observarse en la tabla sucesiva).
La tabla subdivide las regiones del vacío con referencia a la presión indicando las características y los efectos típicos. Con el símbolo ? (lambda) se indica "el libre camino medio", o sea la longitud media del recorrido completado por una molécula entre una colisión y aquella sucesiva; ZA el número de colisiones de la molécula sobre una superficie en la unidad de tiempo y finalmente t formación estrato el tiempo necesario para cubrir con un estrato de gas del espesor de una molécula una superficie limpia en vacío.
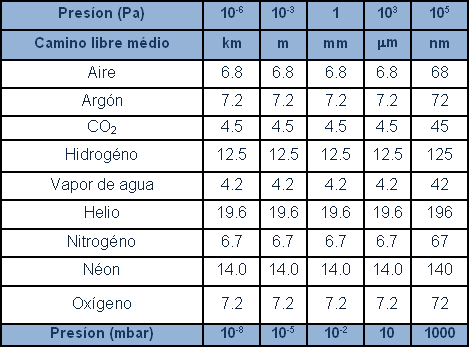
En el cuadro siguiente se relacionan con el recorrido libre medio de los diferentes gases a diferentes presiones.